Какво представлява йонната връзка? Примери за вещества с него и неговите свойства
Има различни видове химическо свързване. Сред тях, ковалентни, метални, van der Waals, водород и йонни. Да видим какво представлява йонната връзка и нейните свойства.

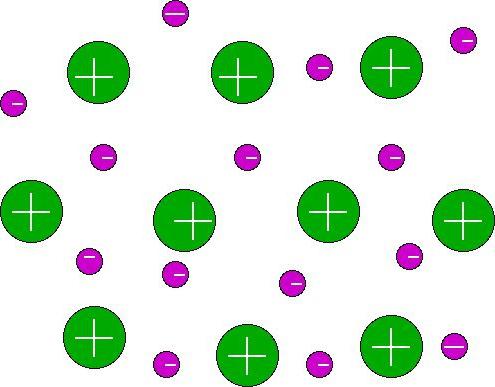
Металният атом лесно се отказва от електрона истава катион. Електронегативният атом, като халогенен атом, лесно взема електрона, образувайки отрицателно зареден йон. Тези заредени частици - аниони и катиони - формират този, който се нарича "йонна връзка". Примери за това са натриев хлорид, калиев бромид, литиев йодид и други метални халиди (предимно алкални).

Няма свойства на насоченост и насищанейонно свързване. Примери за връзки с насоченост и насищане са ковалентни донор-акцепторни връзки. Ненаситена и ненасочена йонна проява се проявява, защото когато йони се свързват към друго зареждане, няма пълно компенсиране на заряда. Други срещуположно заредени йони могат да бъдат прикрепени и т.н. Ето защо се намира максималният брой подобни около йон, но с различен знак. Този брой обаче е ограничен поради взаимното отблъскване на равномерно заредени йони. Равновесието се постига при тяхното взаимно споразумение, което се характеризира с координационен номер. Този индекс зависи от съотношението на радиусите на йоните. Веществата с йонна връзка често имат координация на куб или октаедър и са кристали.
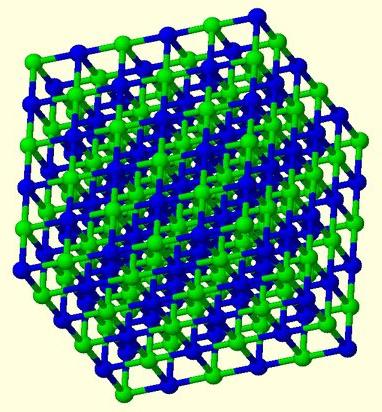
Така че кристалът на солта за натрий - натриев хлорид - има кубична решетка. В него всеки хлорен йон се свързва с шест натриеви йони и всеки натриев йон - с шест хлоридни йони.
В оксиди на алкални и алкалоземни металисе наблюдава и йонна връзка. Примери за такива съединения са калциевият оксид, натриевият оксид и други. Йоните могат да се състоят не само от един атом, но и от няколко. Вътре в такъв комплекс йон е друг, а между самите йони е йонна връзка. Примери: соли на калиев сулфат тип (тук калият е катион, сулфатният йон е анион).
Трябва също така да се отбележи, че свойствата на йонитевещества силно се различават от свойствата на атомите и молекулите на тези вещества. Например, хлорните йони, които са част от натриевия хлорид, са безцветни и без мирис и са подходящи за храна, докато молекулярен хлор, зеленикаво-жълт газ с остър мирис е отрова. И натриевите атоми с вода реагират с експлозията, докато йоните свободно се разтварят.
</ p>>