Йонно свързване
Образуването на химическа връзка включвапроцесът на преразпределение на електронните плътности, които първоначално принадлежат на различни атоми. Във връзка с факта, че електроните на външното ниво с ядрото са свързани най-малко здраво, те също играят основна роля при формирането на връзката. Броят на връзките, които се образуват от атома по време на връзка, се нарича валентност. Съответно, електроните, участващи в образуването на връзка, се наричат валентни електрони. В енергийния план има атоми с различна стабилност. Най-стабилният е един с два или осем електрона на външното ниво (максималното число). В този случай това ниво ще се счита за пълно. Такива завършени нива са характерни за атомите, съдържащи се в благородни газове. В тази връзка, при обикновени условия, те са в състояние на монатомен газ, химически инертен.
За атомите на други елементи са характернинепълни нива. Когато възникне химическа реакция, нивата на външния ред се изпълняват. Това се дължи на отскачането или прикрепването на електрони, както и на образуването на общи двойки. Така се образува ковалентна и йонна връзка. Свойствата на атомите в този случай се проявяват в стремежа им да придобият стабилна електронна обвивка с външно значение. Тя ще бъде или два-електронен, или осем-електронен. Тази закономерност се счита за основа на теорията на химическото свързване.
Образуването на връзката възниква впридружен от разпределението на достатъчно голямо количество енергия. С други думи, комуникацията се формира екзотермично. Това се дължи на факта, че се появяват нови частици (молекули), които при нормални условия имат по-голяма стабилност.
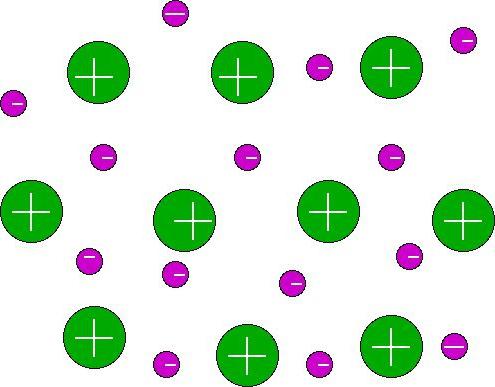
Електронегативността е една от основните характеристики, които показват характера на възникващата връзка. Тази характеристика се проявява в способността на атомите да привличат електрони от други атоми.
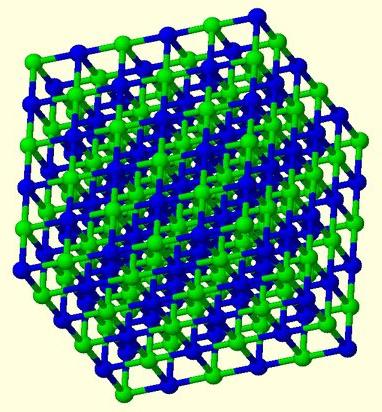
Електростатичното привличане между йоните ейонна химична връзка. Такова взаимодействие е възможно между атоми с рязко различна електронегодност. Йонната връзка образува съответните йонни съединения. Те се състоят от отделни молекули изключително в изпарително състояние. Йонната връзка в съединенията на кристалното (твърдо) състояние осигурява взаимодействие на йони (отрицателни и положителни), разположени редовно. В този случай няма молекули.
Съединения, които се характеризират с йонна връзка,формират елементи от основните подгрупи на 1,2,6,7 групи. Има относително малко такива връзки. Те включват например неорганични соли (NH4C1), солеви органични вещества (аминови соли и други).
Неполярните ковалентни и йонни връзки садва ограничаващи случая на разпределение на електронната плътност. Първият се характеризира с равномерно разпределение между идентични частици (атоми) на свързващото вещество на две електронни облаци. В йонната връзка електронният облак принадлежи почти изцяло на един от атомите. При повечето съединения обаче взаимодействията са на междинно ниво. С други думи, те образуват полярна ковалентна връзка.
Взаимодействие, произтичащо от образуването наобщи електронни двойки, е ковалентна. Ковалентната връзка, която се дължи на взаимодействието на атоми с различна електронегодност, се счита за полярна. Електронната плътност от свързващата електронна двойка се премества в атом, чиято електронегонактивност е по-голяма. Примери за такива молекули са H2S, NH3, Н20 и други. В тези съединения, появата на ковалентна (неполярна и полярна) връзка се дължи на неприсъединените електрони на свързващите атоми.
</ p>>